8.2. ESTRUCTURA MICROSCÓPICA DE LOS METALES
Los metales exceptuando el mercurio, se encuentra en estado sólido a temperatura ambiente, en este estado los átomos se disponen perfectamente ordenados en el espacio constituyendo una estructura cristalina. La estructura espacial de un sólido cristalino se construye a partir de una unidad repetitiva o celda unidad, caracterizada por:
Las distancias a, b, c, aristas del paralelepípedo.
Los tres ángulos a, b, y g que forman las aristas entre sí.
Según los valores de estas aristas y ángulos hay siete sistemas cristalinos, (siete formas geométricas distintas de celda unidad).
|
Tenemos sistemas cristalinos triclínico, monoclínico, ortorrómbico, tetragonal, cúbico, hexagonal y romboédrico.
Los átomos se sitúan en los vértices de estas celdas unidad, la repetición de estas celdas unidad en el espacio dan lugar a redes cristalinas simples. También se pueden situar átomos en los centros de las celdas (red cristalina centrada) o en el centro de las caras (red cristalina de caras centradas).
La mayoría de los metales de interés industrial únicamente cristalizan en tres tipos de redes:
Cúbica centrada en el cuerpo
BBC
|
Cúbica centrada en las caras
FCC
|
Hexagonal compacta
HCP
|
En estas redes cristalinas existen una serie de huecos en los que se pueden introducir átomos extraños a la red, originando las llamadas soluciones de inserción. Otros tipos de soluciones sólidas, llamadas de sustitución, en las que los átomos extraños desplazan a los originales a sus posiciones. En ambos casos son aleaciones de dos metales.
Dos metales en estado sólido son solubles entre sí cuando en la red cristalina de alguno de ellos algunos de sus átomos se pueden sustituir por átomos del otro metal sustitución, o se pueden insertar en los huecos interatómicos de la red (inserción).
Para que dos metales puedan formar una aleación por sustitución es necesario que los tamaños de los átomos de los metales sean parecidos y cristalicen en la misma red.
8.3. CARCATERISTICAS DE LOS METALES
Todos los metales exceptuando el Mercurio (líquido a temperatura ambiente) poseen características comunes derivadas de su estructura interna debida a su vez a las características del enlace metálico. Las propiedades de los metales son:
Elevada conductividad térmica y eléctrica.
Considerable resistencia mecánica.
Gran plasticidad, capacidad para deformarse antes de la rotura.
Elevada maleabilidad.
Reciclables.
Según el contenido en carbono en el arrabio tenemos:
HIERRO
|
ACERO
|
FUNDICIÓN
|
0% < C < 0,03%
|
0,03% < C < 1,67%
|
1,67% < C < 6,67%
|
8.4.1. EL ACERO
- EL ACERO
https://www.youtube.com/watch?v=uOhlKRNvOX0 reciclado de acero
- EL HORNO ELÉCTRICO
- ACERO INOXIDABLE
corte del acero inoxidable
- FUNDICIÓN
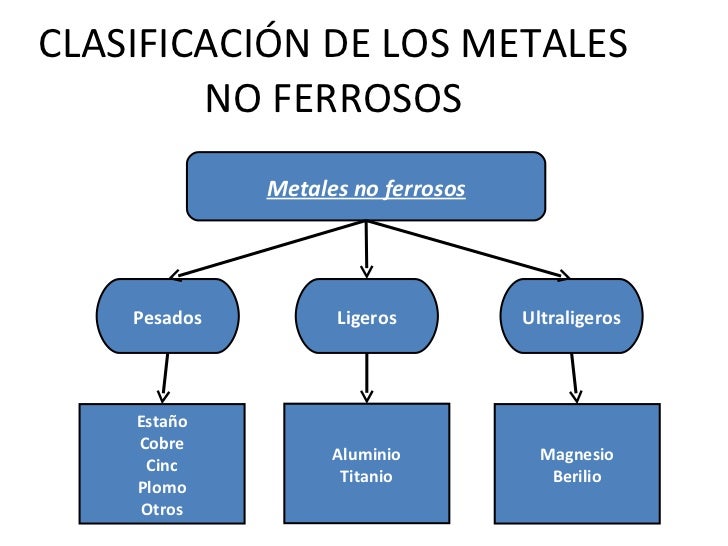
8.5. METALES NO FERROSOS
FABRICACIÓN DE LATAS DE ALUMINIO
8.5.3. EL COBRE
8.5.4. EL NIQUEL
8.5.5. EL TITANIO
8.5.7.EL PLOMO
TRABAJO DE INVESTIGACIÓN
SOBRE METALES NO FERROSOS
8.7. TRATAMIENTOS DE LOS METALES
¿Cómo mejorar las propiedades de los metales?
8.7.1. TRATAMIENTOS TÉRMICO- TÉRMICOS
Bajo tratamiento térmico en la practica se entiende una secuencia metalizada de diferentes procedimientos del "calentamiento" y del "enfriamiento".
8.7.2. ENDURECIMIENTO POR DEFORMACIÓN
- ENDURECIMIENTO POR DEFORMACIÓN
- TRATAMIENTO DE PREVENCIÓN DE CORROSIÓN
METALIZACIÓN
CROMADO